目次
学習ログ 34週目
22日 4時間
23日 4.5時間
24日 4時間
25日 4時間
26日 3時間
27日 9時間
28日 8時間半
*34週目 計37時間(トータル学習時間 1136時間)
岡野198-206
水和水、浸透圧、理想気体と実在気体、ハロゲンなど
無機化学に入りました。
聞いたことのある内容ばかりですが、深く調べていくとエンドレスに勉強できそうです。
ついつい勉強モードでどこまでも調べてしまい、時間が経過することが多かったので、まずは特許に戻るように意識して進めました。
化学の深掘りをしすぎず、特許を見る時間を多くすること、このことを常に意識します。
半導体材料対韓輸出規制
7月1日、経済産業省のサイトには以下のような記載がされました。
包括輸出許可制度の対象から外すということは、日本企業が韓国へ向けて輸出をする場合、個別に輸出許可申請を求めることになります。
今までより時間も手間もかかってくるわけです。
現在、経済ニュースやSNS上では、日本のこの措置に関する情報が飛び交っています。
無機化学の学習でちょうどハロゲン化水素をしているので、今回の包括輸出許可制度の対象から外れることになった品目のひとつ、フッ化水素について触れてみたいと思います。
フッ化水素とは
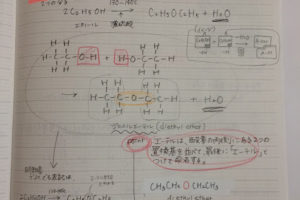
フッ化水素はハロゲン化水素のひとつで、化学式ではHFと表します。
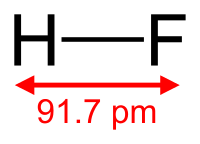
フッ化水素の原料には、蛍石(ほたるいし)というハロゲン化鉱物の一種がつかわれます。
主成分はフッ化カルシウム(CaF2)です。

この蛍石に濃硫酸を加えて加熱すると、無色のフッ化水素(HF)が発生します。
フッ化水素HF分子は、強い極性を表わします。
極性とは、分子内に生じる電気的な偏りのこと。
F(フッ素)原子の電気陰性度3.98、H(水素)原子の電気陰性度 2.20です。
電気陰性度の大きなF原子側に電荷の偏りが生じます。
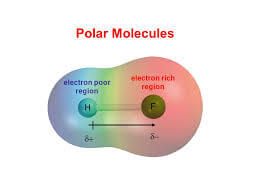
HFはこのように強い極性をもつことで、他のハロゲン化水素とは少し異なる特徴を示します。
フッ化水素HFの主な特性
フッ化水素は、主な特性は3つあります。
特性1、HFの弱酸性
他のハロゲン化水素は強酸ですが、フッ化水素は弱酸性を示します。
なぜHFは弱酸性を示すのか。
そもそも強酸と弱酸の違いとは?定義つけるものは何?
アレニウスの定義によると、酸とは水溶液中においてプロトン(H⁺)を放出する物質のことです。
酸性を表す水溶液中には、電離したプロトンが放出された状態になっています。
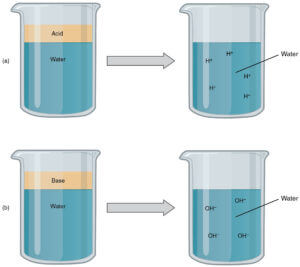
引用:https://www.toppr.com/guides/science/acids-bases-and-salts/acids-and-bases/
酸には、強酸と弱酸があり、水溶液中でほぼ100%電離した状態(電離度がほぼ1)が強酸、一方水溶液中でわずかしか電離しない状態(電離度が小さい)が弱酸になります。
さきほど述べたようにHFは極性が生じるため、一見すると電離して強酸になりそうですが、実際はHFは弱酸になります。
フッ化水素の電離しにくさに理由があります。
電離しにくい理由は以下の2つです。
HF分子間に水素結合が生じる
前に述べたように、HF間には、電子陰性度の差により大きな電荷の偏り、分子内に極性が生じています。電気陰性度の大きなF側に電荷が偏っています。
よって、分子間にもH、Fの間に静電気的な力が生じ、下記のような水素結合が生じます。
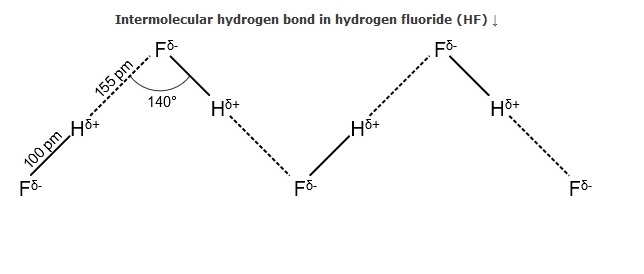 引用:http://www.organicmystery.com/MolecularStructure/HydrogenBonding.php
引用:http://www.organicmystery.com/MolecularStructure/HydrogenBonding.php
上の図では、———- が水素結合を表わします。
水素結合は結合の力が強く、そのためHFは電離しにくい(分子がイオンになりにくい)ので、電離度は低くなります。
結合エネルギーが大きい
HFの結合エネルギーは565kj/molです。
※結合の強さ=結合を引きはがすのに必要なエネルギー
結合エネルギーの強さは、最外殻の電子と原子核の距離が関係しています。
電子と原子核の距離が近ければ(すなわち分子量の小さいもの)は、原子核が電子をひきつける力が強いため、結合エネルギーが大きくなります。
逆に原子核から電子が遠くなればなるほど、原子核が電子をひきつける力が弱いため、結合エネルギーは小さくなります。
よってハロゲン化水素の中で、HFは分子量がいちばん小さいため、結合エネルギーが大きいわけです。
結合エネルギーが大きいため、HFは電離しにくいのです。
HFがバラバラの状態でいるよりは、HFの結合した状態のほうが良い(安定)ということですね。
特性2、沸点が高い
HFの分子間には水素結合ができます。
水素結合により、分子間には強い相互作用が生じることになります。
液体が気体になるということは、分子間の結合が切れて、分子が自由に動き回ることが必要です。
よって、気体になる(沸騰する)ためには、水素結合の強い結合を切る、つまりそれだけエネルギーが必要になります。
下記のように、水素結合をつくるH₂O、HFやNH₃などは、沸点が高くなります。

特性3、ガラスを腐食する
フッ化水素酸は、ガラスの主成分である二酸化ケイ素を溶かす性質があります。
このガラスの腐食性を利用して、表面加工を施して装飾ガラスなども作られています。
JR九州のクルーズトレイン「ななつ星」にも、フッ化水素のガラスへの腐食性を利用した技法が使われているようです。

(参照サイト: https://www.agc.com/hakken/norimono/033_sevenstars.html )
半導体に使用されるフッ化水素
半導体の製造工程において主にクリーニングに、高純度フッ化水素が用いられます。基板上の薄膜に微細な溝や孔を刻み、電子回路等を作るドライエッチング工程においても高純度フッ化水素が使われています。
高純度フッ化水素をつくるメーカーとして、森田化学工業やステラケミファなどが特許出願をしていました。
いくつか特許をみていくと、高純度フッ化水素に求められる高い純度について記載されていることに気が付きました。
以下はステラケミファの特許の一部です。
【公開日】平成6年(1994)7月19日
【発明の名称】超清浄試料採取装置及び超清浄試料採取方法
【0002】
【従来の技術】半導体産業に用いられる超高純度薬品に要求される品質は、金属不純物等がppb以下の純度が要求され、また粒子も少ないことが要求されている。
【0014】この際の超高純度フッ化水素酸としては、金属不純物が1ppb以下のものをいい、またフッ化水素酸の濃度としては5~55%程度である。
以下はハネウェル・インターナショナル・インコーポレーテッド特許の一部です。
【公表日】平成17年9月22日(2005.9.22)
【発明の名称】フッ化水素を含有する高純度無水溶液の製造方法
【0045】
作成される溶液に求められる純度に依存して、必要に応じ、慣用的な従来の方法により無水溶媒(単数又は複数)の不純物含有量を、1ppb未満の範囲、好ましくは100ppt未満の範囲となるよう低減することができる。特に、蒸留法を用いて無水溶媒(単数又は複数)を精製することができ、例えば通常の蒸留又はマイクロ波照射を用いる蒸留により精製できる。
【0046】
従って、本発明は、金属イオン含有量が金属当たり100 ppt未満である高純度溶液も提供する。フッ化水素又はその1以上の塩が単独で又は組み合わせて用いられる、可能性のある全ての用途において、本発明により作成された非常に高純度の溶液を使用することができる。特に、半導体の分野、エレクトロニクス産業、分析化学、及び(バイオ)医薬において、用途が見出される。
















コメントを残す