目次
学習ログ
24日 3時間半
25日 4時間
26日 4時間半
岡野163-164
希薄溶液の束一性(蒸気圧降下、沸点上昇、凝固点降下)、ラウールの法則
勉強スタイルは、朝2時間+夜2時間の分割スタイル
アンモニアと塩化水素は水に溶けやすい

アンモニアと塩化水素は水に溶けやすい、と学習しました。
その理由についてまとめてみます。
水分子の正体
水分子は、酸素原子と水素原子で構成されています。
酸素原子と水素原子は電気陰性度の大きさの違いにより、電荷の偏りが存在。
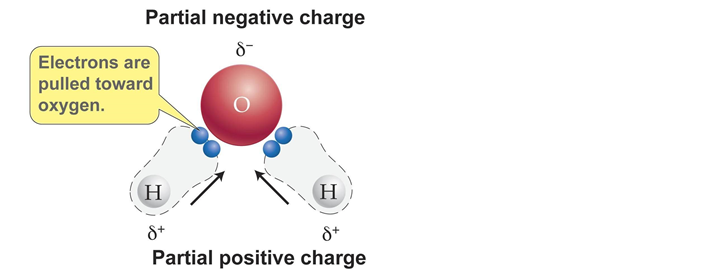
引用元:https://brilliant.org/wiki/polarity-of-a-molecule/
溶液中で溶質と接する水分子は、静電気的な相互作用が安定になるように再配向します。
水分子同士の水素結合
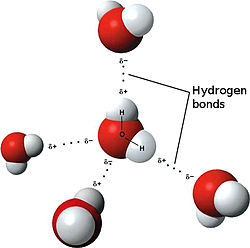
液体の水は、水素結合によって強くつながっています。
水分子の酸素原子は、2つの非共有電子対(ローンペア)をもち、非共有電子対と水分子の水素原子が水素結合を形成します。
下記のように、1つの水分子は4つまで水素結合を形成します。
アンモニアの分子構造
アンモニア分子は、窒素を中心とする正四面体構造です。
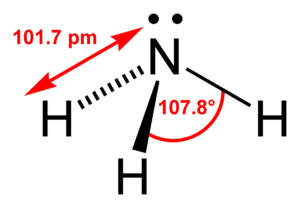 出典:ウィキペディア
出典:ウィキペディア
上の図のように、3つの水素原子と一対の孤立電子対(ローンペア)を持っています。
窒素原子の電気陰性度は3.04、水素原子の電気陰性度は2.20で
電気陰性度の差により、電荷の偏り→極性を生じます。
つまり、窒素原子のほうが電気陰性度が大きいので、
窒素に電子が偏ります。
形状も三角錐の形状であるため、電荷の偏りを打ち消すことができません。
塩化水素はイオン結合ではなく共有結合
塩化水素は、化学式HClの気体です。
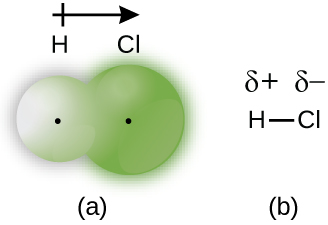
【出典】https://opentextbc.ca/chemistry/chapter/7-2-covalent-bonding/
塩化水素は水溶液中では、H⁺とCl⁻のプラスイオンとマイナスイオンで電離します。
ここで、塩化水素はイオン結合ではないの?という疑問がでてきます。
一般的に、イオン結合は電気陰性度の差が大きいイオン同士の結合です。
原子間で電子が完全に移動して、陽イオンと陰イオンを生じ、
その間の静電気力で両イオンが結合している状態です。
一方共有結合は、イオン結合と比較すると電気陰性度の差は小さいのが特徴です。
原子のまわりにある電子の軌道が重なり、電子を共有することで強い結合を生じます。
塩化ナトリウムはイオン結合で、塩化水素は共有結合です。
それぞれの電気陰性度に注目して、結合を区別できます。
ポーリングの電気陰性度で調べると、塩化水素HClの水素原子の電気陰性度は2.20、塩素原子は3.16です。
一方、塩化ナトリウムの電気陰性度は、ナトリウム原子が0.93 塩素原子3.16と差が大きくなるため、水溶液中でほぼ完全にナトリウムイオンと塩化物イオンに分かれます。
塩化水素は電気陰性度の差により、原子間に極性が生じますが、完全にイオンには分かれません。
このあたりを理解するために、下記のイラストがかなりイメージしやすく、いつも参考にさせてもらっています。
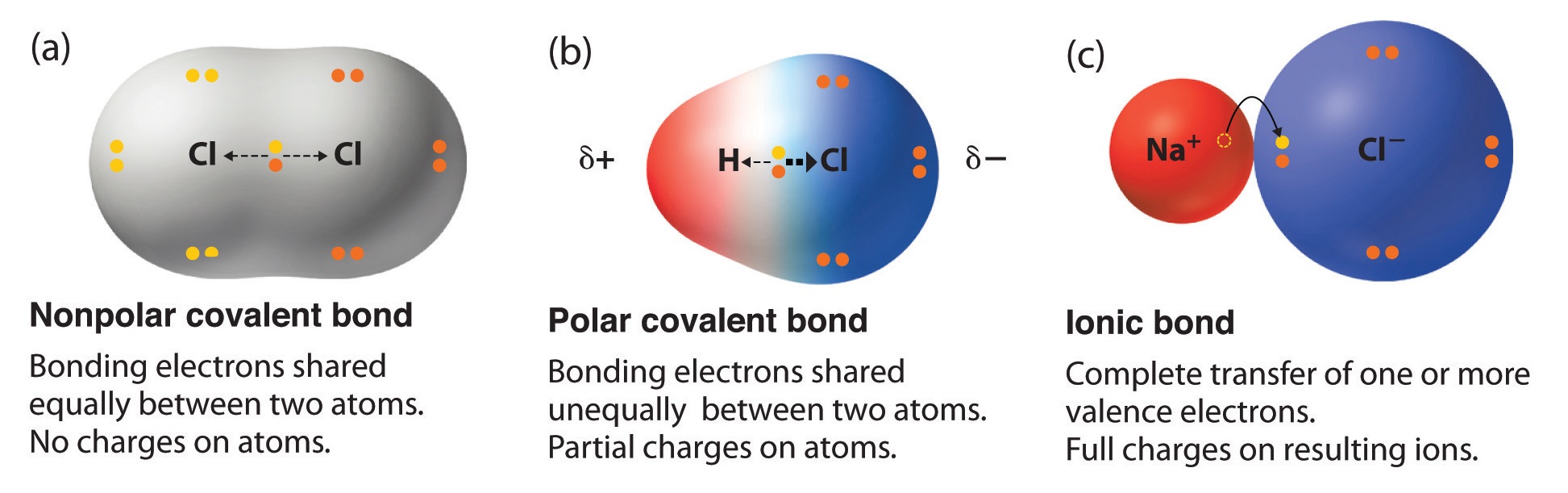
出典:Libretextsより
水に溶けるとは
「水に溶ける」ということは、水和という現象が起こっています。
水和とは、ある化学種へ水の分子が付加することを言います。
前でも述べたように、液体の水は水同士で水素結合しています。
水(溶媒)にアンモニアや塩化水素のような分子(溶質)が溶けるためには、この水分子の水素結合を切って水和という現象を起こさなくてはいけません。
つまり、極性溶質であるアンモニアや塩化水素は、
極性を持たない他の溶質に比べて、極性溶媒である水と電気的な引力によって引き付けられて水和しやすいということです。
(水和しやすい=水に溶けやすい)



















コメントを残す