目次
日常に感じたことを化学に結び付ける
私たちが子供の頃に比べて、気温がずいぶん高くなったと感じます。
特に夏、確実に体感温度が変わりました。
気温上昇の要因のひとつとして、地球温暖化の影響があげられています。
そんななか、二酸化炭素を排出しないエネルギーとして、水素エネルギーが注目されています。
JR東日本が水素を動源力にしたハイブリット鉄道車両を開発する、という記事も見かけました。
特許翻訳者を目指す一人として、水素エネルギーは注視すべきキーワードの一つです。
水素は、環境にやさしい、持続可能なエネルギーとして期待されています。
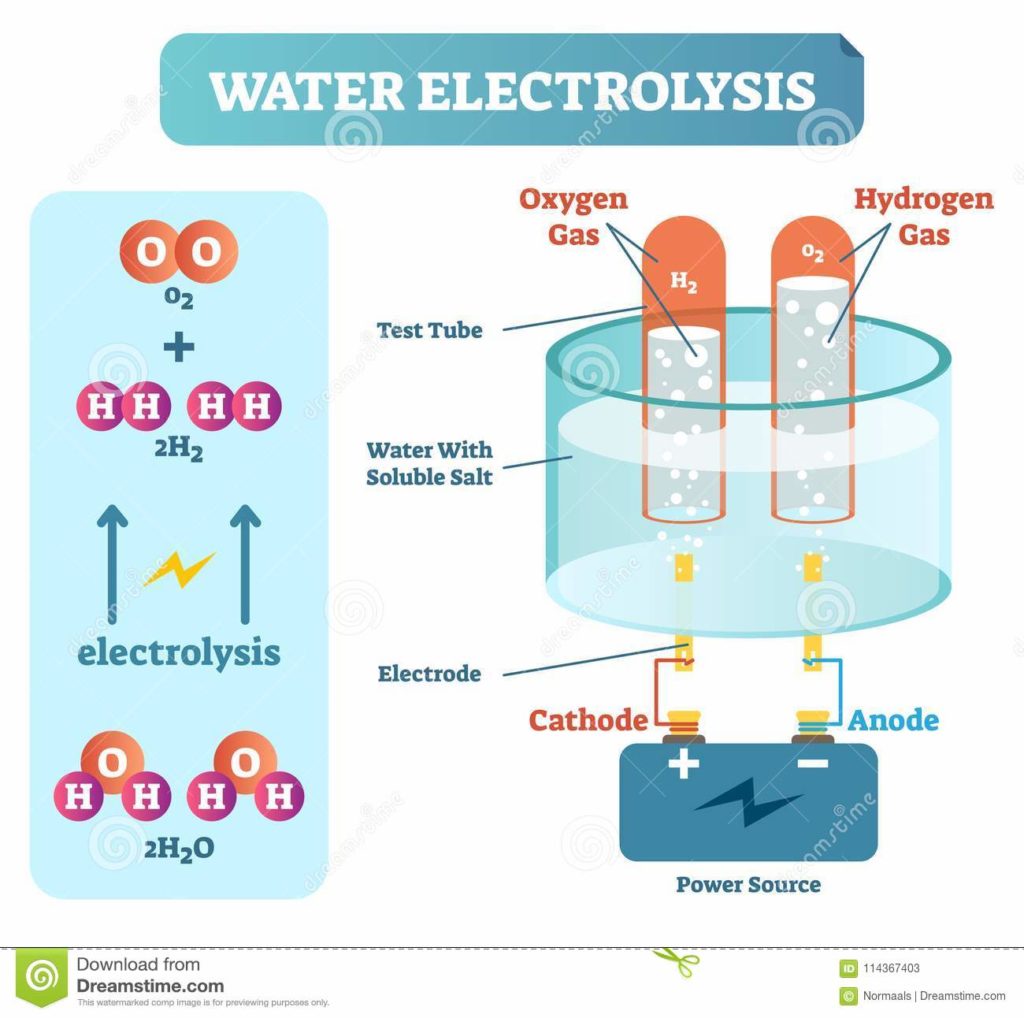
今日は、その水素ができる反応、水の電気分解について取り上げてみます。
水の電気分解 どんな反応?
水の電気分解とは、一言で説明すると
水に電気を流すと、水素と酸素ができるというものです。(かなりざっくりしてますが)
通常、水に電気を流しやすくするため、水酸化ナトリウムを加えた溶液を使います。
電源のプラス側を正極、マイナス側を負極と言います。
電源の負極につながった電極を「陰極」、正極につながった電極は「陽極」です。
電流はプラスからマイナスに流れますが、電子はマイナスからプラスに流れます。
つまり、負極から電子が流れるということです。
反応は、電子の動きに注目
負極から電子が流れいくと書きましたが、その電子は、つながっている陰極に流れます。
陰極には流れてきた電子が集まり、マイナスに帯電します。
一方、陽極はプラスに帯電します。
(陰極では)
マイナスに帯電した陰極には、陽イオンが集まってきます。
溶液中の陽イオンは、水酸化ナトリウムのNa⁺と水に含まれるH⁺です。
イオン化傾向はNa>Hで、Naのほうがイオン化傾向が大きいので、H⁺が電極から流れてきた電子をうけとって(還元反応)、水素 が発生します。
反応式 2H⁺ + 2e⁻ → H₂ ・・・・①
(陽極では)
プラスに帯電した陽極には、陰イオンが集まってきます。
溶液中のマイナスイオンはOH⁻です。OH⁻は陽極で電子を放出して(酸化反応)、酸素 が発生します。
反応式 4OH⁻ → O₂ + 2H₂O + 4e⁻ ・・・・②
①と②の反応をあわせます
電子の数を合わせるために、①を2倍する
①×2 4H⁺ + 4e⁻ → 2H₂
①+②で
2H₂O → 2H₂ + O₂
初めにざっくりと一言で表した、水を分解すると水素と酸素が発生する という反応式になっていますね。
水素をつくりだす、水の電気分解の原理です。
水素はまだまだ奥が深い
水素エネルギーに関する検索をいろいろしていると、作り出した水素をエネルギーとして活用するためには、低コストで大量につくりだすこと、貯蔵や輸送などが課題になっているようでした。
液化水素という新たなキーワードにつながりました。
今日は時間切れ。このキーワードと主力企業をマインドマップにまとめたので、特許へとひろげていきます。




















コメントを残す